Microbiota e rete neuroimmmunoendocrina
|
Getting your Trinity Audio player ready...
|
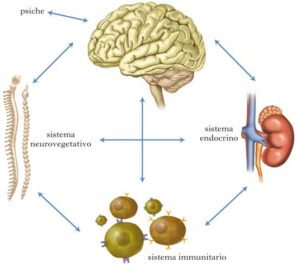
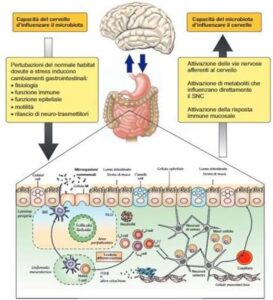
Il sistema nervoso centrale (SNC) e l’intestino (microbiota) interagiscono direttamente come pure comunicano e si modulano reciprocamente grazie a una complessa rete che coinvolge il sistema nervoso periferico (Sistema nervoso autonomo ed enterico), il sistema endocrino (l’asse ipotalamo-ipofisi-surrene) e il sistema immunitario.
 I microrganismi che albergano nel tratto GI sono infatti in grado di modulare l’attivazione delle cellule del sistema immunitario e dell’epitelio intestinale, trasducendo segnali infiammatori (o anti-infiammatori) al SNE (sistema nervoso enterico) e conseguentemente al SNC; d’altra parte, i segnali provenienti dal cervello influenzano la motilità, le modalità sensoriali e secretive del GI. La comunicazione tra cervello e microbiota intestinale è in effetti bidirezionale, nel senso che essi si influenzano vicendevolmente, nel bene e nel male [Cryan JF, Dinan TG, 2012]. Per esempio, una condizione di stress emozionale altera la composizione del microbiota e, a sua volta, una condizione di stress infiammatorio intestinale altera l’attività cerebrale. Ciò avviene perché gli effetti dello stress cerebrale vengono mediati dal rilascio di cortisolo e adrenalina e noradrenalina che modificano l’equilibrio tra ceppi batterici e sistema immunitario locale; al tempo stesso gli ormoni dello stress rendono la barriera intestinale più permeabile ai ceppi patogeni presenti nella mucosa che quindi traslocano all’interno dell’intestino. In direzione opposta, un’alterazione del microbiota intestinale può attivare il sistema immunitario, conducendo a un eccessivo rilascio di TNF-α e altre citochine; tali citochine sarebbero localmente in grado di incrementare la permeabilità intestinale, favorendo l’innescarsi di una attivazione cronica del sistema immunitario; le citochine pro-infiammatorie a loro volta sono in grado di influenzare la funzione cerebrale, alterando la neurogenesi e la ramificazione neuronale nell’ippocampo. Infine, gli acidi grassi a corta catena come butirrato, propionato e acetato sono prodotti metabolici batterici che possono entrare nel flusso sanguigno, viaggiare verso il cervello e agire come modulatori epigenetici controllando l’operatività dei geni nei neuroni; essi agiscono però anche attraverso i recettori classici chiamati “g-protein coupled receptors” (recettori accoppiati alle proteine G (o GPCR), una famiglia di recettori biologici che comprende i recettori colinergici muscarinici, i recettori adrenergici, dopaminergici, serotoninergici, i recettori cannabinoidi e i recettori degli oppiacei e delle purine). I GPCR controllano diversi aspetti della funzione cellulare rappresentando il livello intermedio nella gerarchia organizzativa di gestione della comunicazione tra recettori ed enzimi effettori o canali ionici.
I microrganismi che albergano nel tratto GI sono infatti in grado di modulare l’attivazione delle cellule del sistema immunitario e dell’epitelio intestinale, trasducendo segnali infiammatori (o anti-infiammatori) al SNE (sistema nervoso enterico) e conseguentemente al SNC; d’altra parte, i segnali provenienti dal cervello influenzano la motilità, le modalità sensoriali e secretive del GI. La comunicazione tra cervello e microbiota intestinale è in effetti bidirezionale, nel senso che essi si influenzano vicendevolmente, nel bene e nel male [Cryan JF, Dinan TG, 2012]. Per esempio, una condizione di stress emozionale altera la composizione del microbiota e, a sua volta, una condizione di stress infiammatorio intestinale altera l’attività cerebrale. Ciò avviene perché gli effetti dello stress cerebrale vengono mediati dal rilascio di cortisolo e adrenalina e noradrenalina che modificano l’equilibrio tra ceppi batterici e sistema immunitario locale; al tempo stesso gli ormoni dello stress rendono la barriera intestinale più permeabile ai ceppi patogeni presenti nella mucosa che quindi traslocano all’interno dell’intestino. In direzione opposta, un’alterazione del microbiota intestinale può attivare il sistema immunitario, conducendo a un eccessivo rilascio di TNF-α e altre citochine; tali citochine sarebbero localmente in grado di incrementare la permeabilità intestinale, favorendo l’innescarsi di una attivazione cronica del sistema immunitario; le citochine pro-infiammatorie a loro volta sono in grado di influenzare la funzione cerebrale, alterando la neurogenesi e la ramificazione neuronale nell’ippocampo. Infine, gli acidi grassi a corta catena come butirrato, propionato e acetato sono prodotti metabolici batterici che possono entrare nel flusso sanguigno, viaggiare verso il cervello e agire come modulatori epigenetici controllando l’operatività dei geni nei neuroni; essi agiscono però anche attraverso i recettori classici chiamati “g-protein coupled receptors” (recettori accoppiati alle proteine G (o GPCR), una famiglia di recettori biologici che comprende i recettori colinergici muscarinici, i recettori adrenergici, dopaminergici, serotoninergici, i recettori cannabinoidi e i recettori degli oppiacei e delle purine). I GPCR controllano diversi aspetti della funzione cellulare rappresentando il livello intermedio nella gerarchia organizzativa di gestione della comunicazione tra recettori ed enzimi effettori o canali ionici.
Un altro ruolo importante dei microbi è la produzione di triptofano, p necessario per la serotonina, sintetizzato in particolare dai bifidobatteri.
La verifica della correttezza di questo ragionamento viene anche da studi sperimentali e clinici. C’è una certa evidenza clinica sul ruolo della somministrazione di nel ridurre l’ansia, diminuire la risposta di stress e migliorare l’umore in persone con Sindrome dell’intestino irritabile (IBD) e fatica cronica. Altri studi sia sull’animale che su gli umani hanno mostrato che un cocktail di probiotici (Lactyobacillus helveticus e Bifidobacteria longum) riduce sia l’ansia che il cortisolo e alza la soglia del dolore [Bravo JA et al, 2011]. Viceversa, l’uso di antibiotici nell’animale oltre ad alterare patologicamente l’equilibrio del microbiota (causando disbiosi) altera anche il comportamento, determinando ansia. Interessante è il fatto che viene ridotto il livello del Fattore nervoso di derivazione cerebrale (BDNF) in due aree chiave del cervello, nell’ippocampo e nell’amigdala, con conseguenze negative sull’umore e sulla cognizione.
 Pertanto, lo stress e le emozioni negative incidono sullo stomaco e sull’intestino: tutto ciò che succede a livello cerebrale tende a ripercuotersi sulla funzionalità intestinale.
Pertanto, lo stress e le emozioni negative incidono sullo stomaco e sull’intestino: tutto ciò che succede a livello cerebrale tende a ripercuotersi sulla funzionalità intestinale.
A predominare tra i neurotrasmettitori nel rapporto tra primo e secondo cervello è sicuramente la serotonina, una molecola nota per il suo legame con la depressione e che, come accennato, al 95% viene prodotta dalle cellule dell’intestino.
In caso di infiammazione intestinale si innesca, a livello cerebrale, un forte deficit della molecola con conseguente depressione. Sicché infiammazione, alterazione intestinale e depressione possono essere manifestazioni dello stesso processo. C’è di più.
Secondo uno studio pubblicato su Nature Microbiology [Valles-Colomer et. al., 2019], la carenza di specifici batteri intestinali può predisporre alla depressione e pertanto esiste un chiaro legame tra i batteri che popolano l’intestino e la salute mentale. I ricercatori hanno analizzato i dati di 1.054 individui arruolati nel Flemish Gut Flora Project (FGFP), e hanno rilevato che due gruppi di batteri, coprococcus e dialister, erano consistentemente ridotti nell’intestino di persone con diagnosi di depressione, a prescindere dal trattamento antidepressivo. In un sottogruppo del campione gli esperti hanno anche correlato l’attività di alcuni batteri intestinali alla salute mentale; in particolare, i batteri sono capaci di produrre una sostanza simile alla “dopamina” (neurotrasmettitore associato anche a senso di gratificazione) che è risultata legata a maggiori livelli di salute mentale. Gli stessi ricercatori hanno quindi convalidato i loro risultati esaminando una coorte indipendente di 1.063 individui dello studio Dutch LifeLines DEEP e un gruppo di pazienti con disturbo depressivo maggiore resistente al trattamento. Gli esperti hanno notato anche che batteri delle famiglie faecalibacterium e coprococcus sono risultati costantemente associati a indicatori di una maggiore qualità della vita. Significativo è il fatto che entrambi i batteri producono butirrato, un acido grasso a catena corta che rinforza la barriera epiteliale e riduce l’infiammazione intestinale; di entrambi è stata notata una certa scarsità in concomitanza con malattie infiammatorie intestinali e depressione.
Il lavoro richiama altresì uno precedente condotto nei topi da ricercatori giapponesi del RIKEN Center for Integrative Medical Sciences in Giappone e pubblicato sulla rivista Nature [Furusawa et al., 2013], che ha identificato il meccanismo molecolare mediante il quale i batteri intestinali influenzano i processi messi in atto dal sistema immunitario per ridurre l’infiammazione. Il butirrato, un prodotto di scarto della digestione delle fibre alimentari ad opera dei batteri intestinali, fungerebbe da “interruttore” epigenetico in grado di stimolare il sistema immunitario attraverso l’induzione della produzione di cellule T regolatorie nell’intestino. In particolare, l’acido butirrico agisce sulle cellule T naïve promuovendone la loro differenziazione in cellule T regolatorie. Ciò sarebbe reso possibile grazie a variazioni epigenetiche che regolano l’espressione dei geni responsabili per la differenziazione delle cellule T naïve in cellule T regolatorie. Queste cellule sono importanti per il contenimento di risposte infiammatorie. Per inciso, tale scoperta fornisce evidenza a supporto del possibile impiego di butirrato come terapia per le malattie infiammatorie intestinali (IBD), come il morbo di Crohn, le allergie e le malattie autoimmuni.
Si ricorda che l’acido butirrico è un acido grasso saturo a catena corta che si trova naturalmente nel latte e nei derivati come il burro crudo, il formaggio e altri prodotti lattiero-caseari; è anche prodotto dai batteri dell’intestino quando vengono consumati determinati carboidrati e fibre ed è la fonte di energia preferita dei batteri che vivono nel colon, ragioni per cui ha un ruolo determinante (positivo) sulla salute intestinale. In effetti, all’acido butirrico sono attribuite diverse proprietà benefiche che spaziano da quelle antinfiammatorie a quelle che prevengono lo sviluppo di cellule cancerogene. Inoltre l’acido butirrico contribuisce a migliorare la sensibilità all’insulina e l’equilibrio energetico, stimola gli ormoni dell’intestino e aumenta la sintesi di leptina (importante nella regolazione dell’appetito), stimola la proliferazione delle cellule sane del colon mentre stimola l’apoptosi nelle cellule tumorali.
Gli psicobiotici
E’ oggi possibile operare sul microbiota per gestire meglio lo stress, migliorare l’umore, curare ansia e depressione, e vari problemi di salute mentale e cognitivi grazie al ricorso a psicobiotici.
Gli psicobiotici sono organismi batterici viventi che, se ingeriti in quantità adeguate, producono un beneficio per la salute nei pazienti affetti da malattie psichiatriche ma anche nei sani [Dinan et al., 2013], producendo e veicolando “sostanze neuroattive con un effetto sull’asse mente-intestino”. Questa definizione, coniata nel 2013, è troppo limitante se ci si basa sulla più recente ricerca che dimostra che non c’è bisogno di avere una depressione clinica, un disturbo d’ansia, o qualche altro disturbo psichiatrico per fruire dei benefici prodotti dagli psicobiotici sul cervello [Tillisch K et al., 2013]. Tra i meccanismi d’azione, vanno ricordati:
- attraverso la loro capacità di produrre vari composti biologicamente attivi, come i neurotrasmettitori. Diverse molecole con funzioni neuroattive come l’acido gamma-amminobutirrico (GABA), la serotonina, le catecolamine e l’acetilcolina possono essere prodotti dai batteri intestinali [Wall R et al., 2014]; quando questi neurotrasmettitori sono secreti all’interno dell’intestino, possono attivare cellule all’interno del rivestimento epiteliale che a loro volta rilasciano molecole che stimolano la funzionalità cerebrale e influenzano il comportamento;
- esercitando effetti sul sistema di risposta allo stress del corpo, che coinvolge il cervello e le ghiandole surrenali [Ait-Belgnaoui A et al., 2014]. Questo sistema, noto come asse ipotalamo-ipofisi-surrene (HPA), diventa disfunzionale in caso di stress cronico o malattia. Quando si verifica una disfunzione dell’asse HPA, la produzione ritmica di cortisolo e di altri ormoni legati allo stress (ADH, ACTH) diventa perturbata, con conseguenti disturbi dell’umore e problemi cognitivi [Watson S, Mackin P., 2006];
- attraverso la loro azione anti-infiammatoria [Petra AI et al., 2015]. I livelli cronicamente elevati di infiammazione in tutto il corpo e nel cervello sono ormai noti essere una delle principali cause della depressione e di altri disturbi dell’umore e cognitivi. Questa infiammazione può derivare dall’intestino, e alcuni psicobiotici apportare i loro effetti benefici nel cervello abbassando l’infiammazione.
La ricerca sta cominciando a identificare quali probiotici abbiano effetti sul sistema nervoso e quali siano questi effetti.
Uno studio clinico è stato condotto su pazienti con disturbi depressivi maggiori: alcuni hanno assunto per otto settimane un integratore prebiotico costituito da Lactobacillus acidophilus, Lactobacillus casei, Bifidobacterium bifidum (2 miliardi di CFU ciascuno), altri un placebo [Akkasheh G et al., 2016]. Dopo otto settimane, i pazienti che hanno ricevuto il probiotico avevano diminuito in modo significativo i punteggi totali sulla Beck Depression Inventory, un test ampiamente utilizzato per misurare la gravità della depressione, rispetto ai pazienti che avevano assunto il placebo. Inoltre, avevano una significativa diminuzione della infiammazione sistemica, come misurato dal hs-CRP; inoltre i livelli di insulina erano significativamente più bassi, si era ridotta la resistenza all’insulina, e si era verificato un significativo aumento di glutatione, un antiossidante.
Altri psicobiotici hanno conseguenze benefiche sull’umore e sui sintomi di ansia, ma anche in persone senza questi disturbi. In uno studio per analizzare i possibili effetti su ansia, depressione, stress in volontari sani, è stato utilizzato un probiotico che contiene Lactobacillus helveticus r0052 e Bifidobacterium longum R0175 (Probio’Stick®), ed è stato dimostrato che esso allevia lo stress psicologico, in particolare la depressione, la rabbia, l’ostilità, e l’ansia quando assunto per 30 giorni [Messaoudi M et al., 2010]. I ricercatori hanno concluso che L. helveticus r0052 e B. longum R0175 hanno effetti psicologici benefici nei soggetti sani. Possono contribuire a rafforzare l’umore e alleviare l’ansia nelle persone affette da varie malattie croniche.
In un altro studio controllato, i pazienti con sindrome da stanchezza cronica sono stati divisi in gruppi in cui uno ha ricevuto 24 miliardi di unità formanti colonie di Lactobacillus casei, ceppo Shirota, e un altro un placebo ogni giorno per due mesi con placebo nei pazienti [Rao AV et al., 2009]. Le persone che avevano assunto il probiotico avevano una significativa diminuzione dei sintomi di ansia.
Molti psicobiotici supplementari hanno dimostrato di poter curare la depressione e l’ansia in studi su animali. Il Lactobacillus plantarum, ceppo PS128, per esempio, è noto per l’effetto di aumentare la dopamina e la serotonina e di diminuire i comportamenti di depressione nei topi [Liu WH et al., 2016]. Nei topi depressi che sono stati sottoposti a stress precoce, questo stesso psicobiotico diminuisce il cortisolo, normalizza il sistema di risposta allo stress (HPA), e diminuisce la depressione [Liu YW et al., 2016]. Sia il Bifidobacterium longum e sia il Bifidobacterium breve riducono l’ansia e migliorano le prestazioni nei test cognitivi nei topi [Savignac HM et al., 2014, 2015].
E’ stato anche dimostrato che una bevanda di latte fermentato (kefir) contenente il Lactobacillus casei, ceppo Shirota, ha impedito un aumento di cortisolo ed ha aumentato i livelli di serotonina negli studenti di medicina stressati [Kato-Kataoka A et al., 2016]. Inoltre, la bevanda probiotica ha diminuito i sintomi fisici legati allo stress come dolore addominale e sintomi del raffreddore. Gli autori dello studio hanno concluso che l’assunzione di Lactobacillus casei, ceppo Shirota “può esercitare effetti benefici per prevenire l’insorgenza di sintomi fisici nei soggetti sani esposti a situazioni di stress.”
Altri probiotici contenenti Lactobacillus helveticus hanno anche dimostrato, in studi condotti su animali, di poter ridurre la depressione legata allo stress e all’ansia, influenzando la serotonina, il cortisolo, e altri composti neuroattivi [Ohland CL et al., 2013]. Ad esempio, il Lactobacillus helveticus r0052 combinato con il Lactobacillus rhamnosus R0011 ha normalizzato i comportamenti simili all’ansia e le carenze di apprendimento e di memoria nei ratti immuno-deficienti con disfunzioni dell’asse HPA [Smith CJ et al., 2014].
Il Lactobacillus helveticus NS8 è stato confrontato con l’SSRI (citalopram) nei ratti con depressione, ansia e disfunzioni cognitive a causa dello stress cronico [Liang S et al., 2015]. Il prebiotico ha funzionato meglio del citalopram nel ridurre ansia (indotta da stress), depressione e disfunzioni cognitive, abbassando il cortisolo e riportando i livelli di serotonina e di altri neurotrasmettitori cerebrali alla normalità.
Anche i prebiotici[1] possono agire come importanti regolatori dell’umore e della funzione del cervello. Non sono organismi vivi come i probiotici, ma sono sostanze vegetali che stimolano la proliferazione dei batteri positivi intestinali. In un recente studio è stato dimostrato che essi riducono la secrezione dell’ormone dello stress, il cortisolo, e migliorano l’elaborazione emotiva in volontari sani. I partecipanti hanno ricevuto uno dei due prebiotici (frutto-oligosaccaridi, FOS, o Bimuno-galactooligosaccharides, B-GOS) oppure un placebo (maltodestrine) al giorno per tre settimane. I livelli di cortisolo al mattino erano significativamente più bassi dopo l’assunzione di B-GOS rispetto a chi aveva assunto il placebo. I partecipanti che avevano assunto B-GOS hanno anche mostrato aumenti positivi sulla vigilanza e attenzione, che è un’indicazione che il prebiotico ha avuto effetti anti-ansia. Nessun effetto è stato trovato dopo la somministrazione di FOS [Schmidt K et l., 2015].
Le persone con l’intestino irritabile spesso hanno ansia e/o depressione, condizioni correlate direttamente con la disbiosi e con la diminuzione dell’attività intestinale e della diversità microbica [Zhou L, Foster JA., 2015]. Uno studio ha trovato che una miscela prebiotica contenente galactooligosaccaride ha dato benefici sull’ansia nella sindrome dell’intestino irritabile [Silk DB et al., 2009]. Il trattamento giornaliero con questa miscela per 4 settimane ha ridotto i punteggi di ansia e ha avuto un notevole impatto positivo sulla qualità della vita.
In conclusione, nel complesso, i risultati di questi studi dimostrano che gli psicobiotici hanno il potenziale di avere un impatto positivo sulla funzionalità del cervello, sul miglioramento dell’umore, sul trattamento della depressione e dell’ansia, e aiutano a gestire lo stress. I migliori psicobiotici ed i relativi dosaggi devono ancora essere determinati. In generale sono raccomandati almeno 10 miliardi di CFU al giorno per la maggior parte dei probiotici, tra cui gli psicobiotici, ma possono anche essere utili apporti superiori o inferiori. Basta fare una prova per almeno un mese prima di decidere se funzionano o meno.
Principali psicobiotici
- Bifidobacterium bifidum – Questa famosa specie psicobiotica non solo combatte i patogeni come coli e Candida, ma riduce l’infiammazione sia nell’intestino che nel cervello. Gli studi dimostrano che alte dosi di questo batterio sono neuroprotettive e aiutano a prevenire l’Alzheimer.
- Bifidobacterium longum – Supporta il normale equilibrio dei neurotrasmettitori nel corpo. Questo batterio è uno psicobiotico anti-ansia. Uno studio condotto con l’associazione Lactobacillus helveticus R0052 e Bifidobacterium longum R0175 ha dimostrato che questa è in grado di rafforzare l’umore, alleviare lo stress psicologico, in particolare la depressione, la rabbia, l’ostilità e l’ansia; gli effetti benefici si esercitano anche nei soggetti sani.
- Coprococcus e dialister sono due ceppi di batteri intestinali consistentemente ridotti nell’intestino di persone con diagnosi di depressione
- Faecalibacterium prausnitzii – Uno dei psicobiotici più potenti perché tra i principali produttori di butirrato, potente antinfiammatorio, che protegge il rivestimento interno dell’intestino, accelera il metabolismo e aiuta a regolare la glicemia. Bassi livelli di prausnitzii si trovano nelle persone con depressione cronica, morbo di Crohn, obesità e persino asma.
- Lactobacillus brevis – Abbondante nei crauti, questo psicobiotico aumenta i livelli del fattore neutrofico cerebrale (BDNF, Brain Derived Neurotropic Factor) nel cervello. La produzione di BDNF migliora le capacità di apprendimento e aiuta a mantenere un umore positivo.
- Lactobacillus casei – Il miglioramento dei livelli di glutatione è la chiave per ridurre al minimo gli effetti dannosi delle tossine sul cervello. Questa specie psicobiotica ha dimostrato non solo di elevare i livelli di glutatione, ma il casei aiuta anche a mantenere le cellule sensibili all’insulina. Il L. casei ceppo Shirota presente nel kefir (una bevanda ricca di fermenti lattici ottenuta dalla fermentazione del latte), è in grado di impedire l’aumento di cortisolo, ridurre i sintomi fisici legati allo stress, far aumentare i livelli di serotonina.
- Lactobacillus gasseri – Questo psicobiotico è capace di far abbassare i livelli di cortisolo, combattere lo stress, avere un sonno di qualità.
- Lactobacillus helveticus – Questo ceppo di batteri è quello che “risolve i problemi”. Gli studi dimostrano che la presenza di elevate quantità di helveticus nell’intestino migliora la capacità di superare i problemi.
- Il Lactobacillus helveticus NS8 si è dimostrato in grado di ridurre l’ansia indotta da stress, depressione e disfunzioni cognitive (funzionando meglio del citalopram, un inibitore selettivo del riuptake della serotonina).
- Lactobacillus plantarum – Presente in kimchi, crauti e quasi ogni altra verdura coltivata, questo batterio protegge da un intestino con perdite. Studi scientifici suggeriscono che questo psicobiotico può aiutare la risposta allo stress. Si tratta di uno psicobiotico che ha influenza sull’aumento della dopamina e della serotonina e di alleviare I comportamenti depressive nei topi, in cui normalizza il Sistema di risposta allo stress (HPA).
- Lactobacillus rhamnosus – E’ considerate il re degli psicobiotici. Ha un’influenza benefica sui livelli di cortisolo (l’ormone dello stress). Cambatte l’ansia cambiando l’espressione dei recettori del GABA, il principale neurotrasmettitore inibitorio e rilassante nel sistema nervoso centrale. Riporta anche a livelli normali un neurotrasmettitore cruciale per la felicità, la serotonina. Negli animali, questo batterio è efficace nel trattare il disturbo ossessivo-compulsivo quanto la fluoxetina.
Il Lactobacillus rhamnosus HN001 può aiutare ad avere un “buon sonno”.
- Mycobacterium vaccae – Migliora l’umore e attiva i centri di apprendimento del cervello; sarebbe anche capace di ridurre l’ansia e migliorare la risposta allo stress.
[1] I probiotici sono organismi vivi che apportano benefici al nostro organismo e che possiamo assumere tramite alimenti o integratori. I prebiotici invece sono sostanze organiche, come le fibre, che stimolano la crescita dei batteri buoni che costituiscono il microbiota.